Fecha de revisión: 05-04-2016
1
MONOGRAFÍA DEL PRODUCTO
NOMBRE DEL PRODUCTO: SUSY® DROSPIRENONA 3 MG Y ETINILESTRADIOL 0.03 MG TABLETAS
RECUBIERTAS
NOMBRE GÉNERICO Y CONCENTRACIÓN DE LOS PRINCIPIOS ACTIVOS: DROSPIRENONA 3 mg y
ETINILESTRADIOL 0.03 mg POR TABLETA RECUBIERTA
FORMA FARMACÉUTICA: TABLETAS RECUBIERTAS
PRINCIPIOS ACTIVOS
DROSPIRENONA
Nombre químico (CAS)1
’S,6R,7R,8R,9S,10R,13S,14S,15S,16S)-
, ’, ’, , , , , , , , , , , , , -Hexadecahidro-10,13-
dimetilespiro[17H-diciclopropan[6,7:15,16]ciclopenta[a]fenantreno-
, ’ ’H)-furan]- , ’ H)-diona
Fórmula2
C24H30O3
Peso Molecular [g/mol] 1
366.49
Número CAS2
67392-87-4
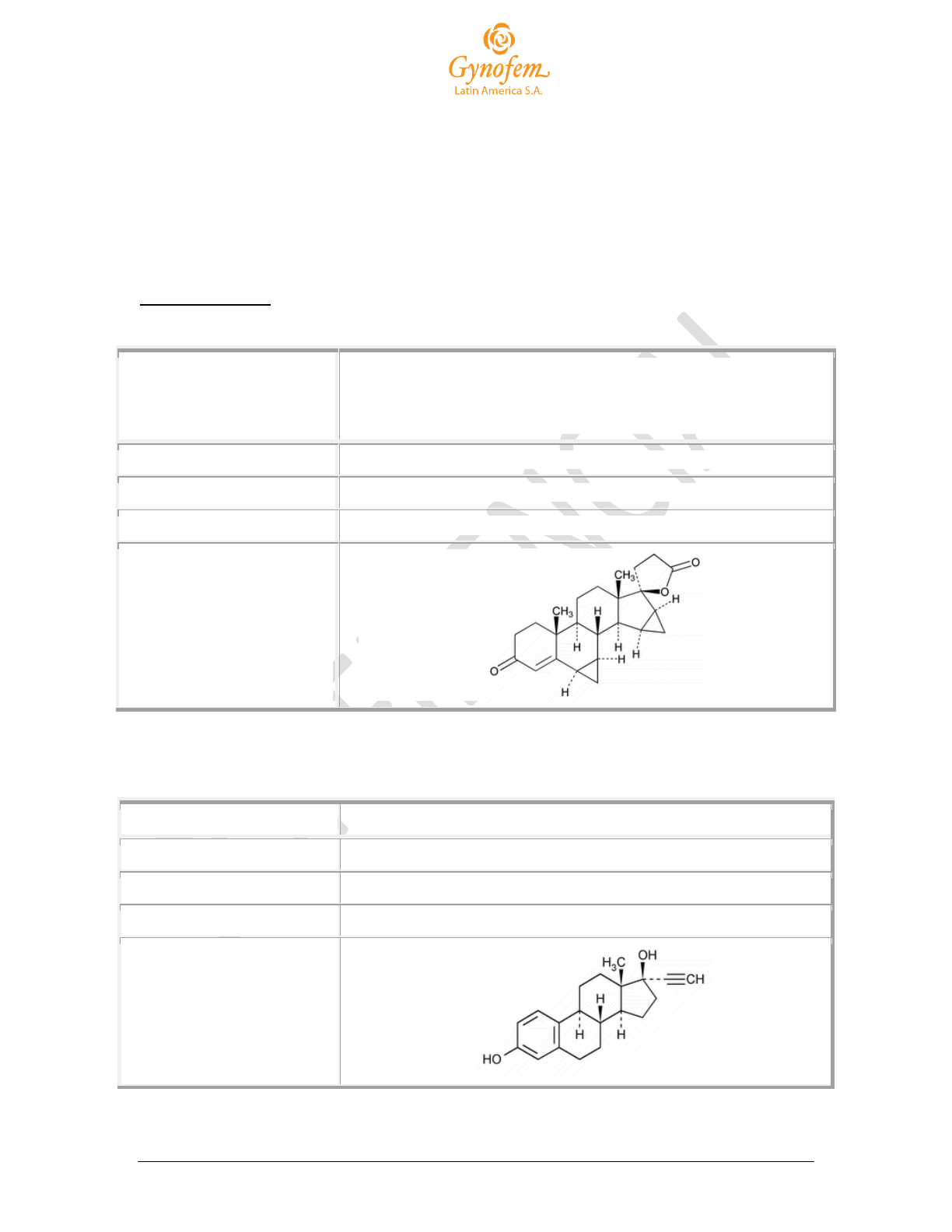
Estructura química2
Fuente:
1
The Merck Index: Drospirenone monograph. 14th ed. Whitehouse Station, NJ, USA: Merck & Co., Inc.; 2006.
2
USP Monographs: Drospirenone. © 2011 The United States Pharmacopeial Convention.
ETINILESTRADIOL
Nombre químico (CAS)3
α -19-Norpregna-1,3,5(10)-trien-20-ine-3,17-diol
Fórmula4
C20H24O2
Peso Molecular [g/mol]4
296.40
Número CAS3
57-63-6
Estructura química4
Fuente:
3
The Merck Index: Ethinyl Estradiol monograph. 14th ed. Whitehouse Station, NJ, USA: Merck & Co., Inc.; 2006.